前沿 | 浙大团队将无载体自组装纳米粒载入可溶微针,实现对肿瘤部位的高效、精准递送
近年来,将微针用于肿瘤治疗的报道日益增多,基于“光敏剂纳米药物”的光动力疗法(Photodynamic Therapy,PDT),在黑色素瘤治疗中表现出良好的应用前景。
然而,纳米修饰过程中大量引入高分子材料所造成的低载药量、潜在的系统毒性,以及常用静脉注射引起的皮肤病灶部位浓度低和全身多器官分布等问题,限制了其进一步的临床转化。
为解决这一难题,浙江大学药学院高建青教授团队将无载体自组装纳米粒(Nanoassemblies Of a Chlorin e6,L-Ce6 NAs)载入可溶微针,实现了对肿瘤部位的高效、精准递送。
图|L-Ce6 微针贴片(来源:高建青)
其中,L-Ce6 纳米粒的设计是基于之前与浙江大学医学院王杭祥研究员的合作基础(Nano Today 2021, 36, 101030)[1]。
王杭祥研究团队长期致力于小分子前药自组装体的开发,其设计的基于 Ce6 的小分子前药自组装体具有优于游离Ce6分子的水溶性和肿瘤细胞摄取能力。本研究将其引入到课题组目前专注的微针技术平台上,以期实现对浅表皮肤肿瘤的有效治疗。
12 月 3 日,相关论文以《一种简便的低剂量光敏剂结合可溶解微针为基础的复合体系激活抗肿瘤免疫反应并产生远端效应》(A Facile Low-Dose PhotosensitizerIncorporated Dissolving Microneedles-BasedComposite System for Eliciting AntitumorImmunity and the Abscopal Effect)为题发表在 ACS Nano 上,浙江大学高建青教授为通讯作者[2]。
图|相关论文(来源:ACS Nano)
该研究揭示了“光敏剂纳米递药系统”研究热背后的逻辑,基于 PDT 的纳米递药系统中,所使用的光敏剂需要在光激发下产生高浓度活性氧(Reactive Oxygen Species,ROS),实现对肿瘤组织的快速消融。
针对恶性黑色素瘤这类快速生长的肿瘤具有较好的疗效,其所涉及的光控手段微创且时空可控,具有较高的用药安全性。
越来越多的研究表明,PDT 对机体的免疫激活具有一定的作用。因此,PDT 在肿瘤治疗领域仍是很有前景的策略。
将无载体自组装纳米粒运输至皮肤下 200 ~ 500 微米处,实现精准递送
该团队将 L-Ce6 NAs 载入可溶微针制备得到含光敏剂 Ce6 纳米粒的微针贴片(Chlorin e6 Microneedles,L-Ce6 MNs)。该微针针体高大约 500 微米,具有足够的机械强度,能够直接突破角质层屏障刺入皮肤深层抵达肿瘤部位,然后微针针体材料溶解,释放出 L-Ce6 NAs,并被肿瘤细胞摄取。
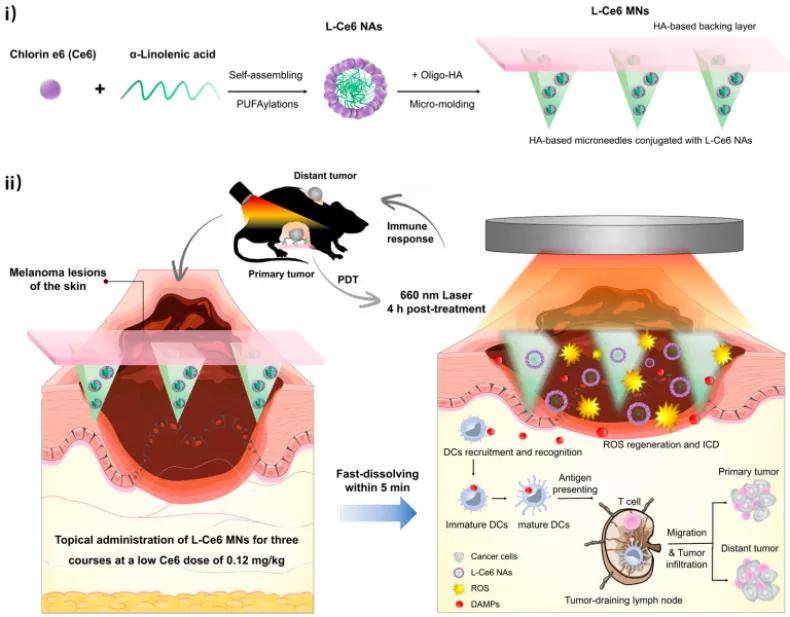 图|微针基复合系统与低剂量光敏剂示意图(来源:ACS Nano)
图|微针基复合系统与低剂量光敏剂示意图(来源:ACS Nano)
高建青表示:“游离的 Ce6(Chlorin e6)水溶性比较差,该分子含有三个羧基,负电性和极性较大,细胞摄取效率较低。将其制备成纳米粒后发现,不仅可以提高药物的水溶性,还可促进其细胞内吞,进而产生出更好的抗肿瘤疗效。”
 图|高建青(来源:高建青)
图|高建青(来源:高建青)
值得关注的是,纳米药物的光动力疗法除了被广泛应用于皮肤肿瘤的治疗,对于其他皮肤类疾病譬如银屑病、特应性皮炎、痤疮、疤痕以及尖锐湿疣等也展现出了较好的治疗效果,在临床及医疗美容领域具有一定的应用前景。
微针贴片可不借助其他免疫治疗手段,实现远端抑瘤效应
尽管纳米递送系统在多个应用中有明显的优越性,但在进一步临床转化中仍存在一定的阻碍。
一方面,现阶段纳米系统多采用聚合物包载的方式进行递药,这会造成药物在体内循环中的不可控释放,大量聚合物的引入会造成低载药量和潜在的系统毒性。
另一方面,纳米药物在靶部位的有效蓄积是其能否发挥有效治疗的关键;此外,纳米制剂制备复杂,批次间可控性 较差,成本高。
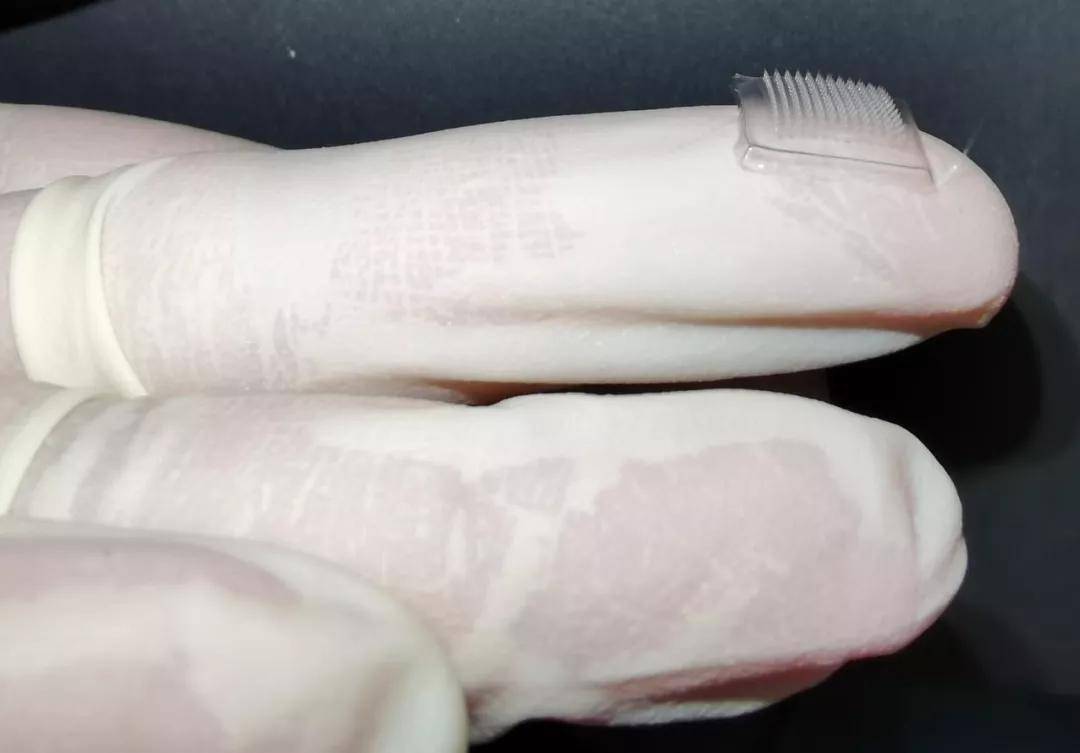 图|该团队制备的微针贴片(来源:高建青)
图|该团队制备的微针贴片(来源:高建青)
该团队所研究的微针可以突破皮肤的角质层屏障,直接将药物通过微孔道递送至皮肤深处。该高效微创递药载体在治疗黑色素瘤时具有以下优点:
第一,微针贴片在制备过程中,可机动调节贴片大小及微针长度,能在不规则的浅表性皮肤肿瘤组织处实现精准递送,有利于药物均匀分布在肿瘤部位。
第二,微针给药能够降低药物的全身渗漏,从而避免进一步的全身毒副作用 ,同时低痛的特性也为患者提供了更好的顺应性 。
第三,微针本身可作为一种“机械性佐剂”,通过皮肤局部微创释放细胞因子来增强机体的免疫应答,有望增敏 现有的免疫疗法。
第四,微针还可用于眼部、口鼻腔粘膜、指甲、阴道等处的药物递送,这为肢端和黏膜型黑色素瘤的治疗提供了可能,而这两种黑色素瘤在亚洲地区较为多发。
在模型动物给药时,由于小鼠皮肤黑色素瘤细胞皮下瘤模型中,肿瘤呈半固体状态,当微针按压给药时有可能挤破肿瘤,从而造成瘤细胞扩散。
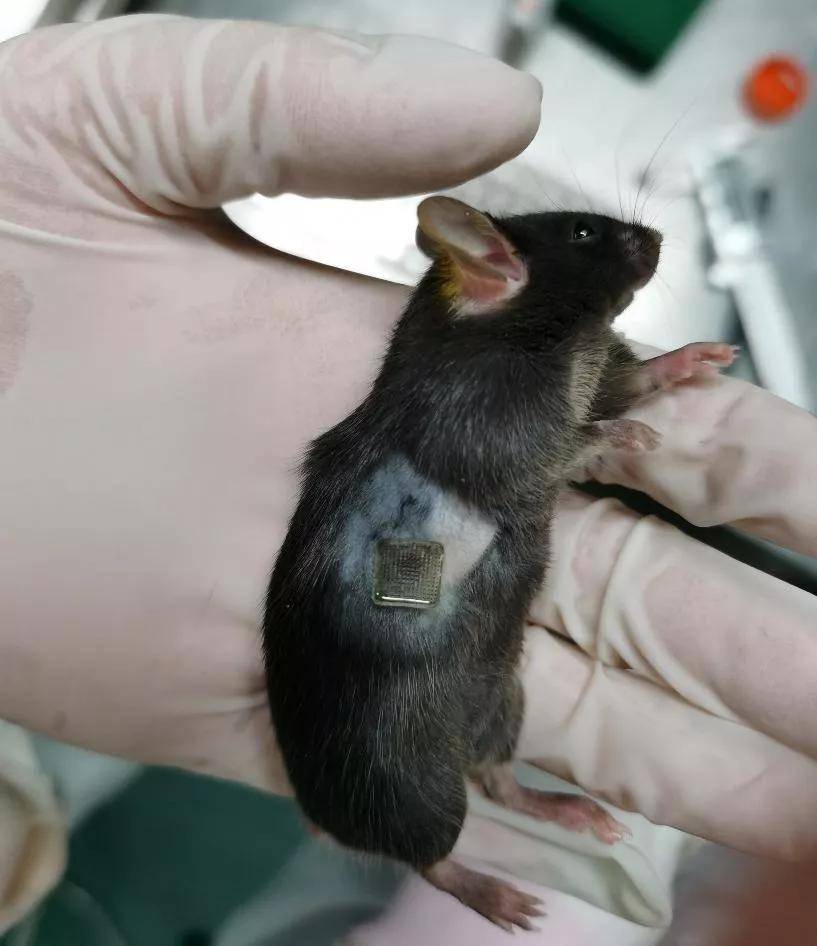 图|荷瘤鼠微针给药图片(来源:高建青)
图|荷瘤鼠微针给药图片(来源:高建青)
因此,该团队对给药时间、初次给药时的肿瘤大小、贴片尺寸和背衬材料都进行了优化。
高建青表示:“本研究在肿瘤的治疗上仍需要采用多次给药的方式,后续可通过对整个载体的优化,实现单次给药,将具有更重要的意义。
另外,红光的组织穿透能力有限,后续可结合激发波长更长的光敏材料进一步地提升对肿瘤的治疗。”